Откуда берутся опухоли? Откуда берётся рак?
Автор статьи: к.м.н. Григорчук Александр Юрьевич

Ключ к пониманию возникновения рака и других злокачественных опухолей лежит в устройстве и функционировании клеток организма. C возникновением опухолей связаны некоторые из жизненно важных механизмов отвечающих за нормальное функционирование клеток и организма в целом, это:
- механизмы отвечающие за сохранение и передачу генетической информации, содержащейся в молекулах ДНК в каждой человеческой клетке
- механизмы отвечающие за деление клеток
- механизмы отвечающие за взаимодействие (обмен информацией) между соседними клетками
- механизмы отвечающие за взаимодействие между клетками и организмом в целом (гормональные взаимодействия)
Опухоли возникают преимущественно из-за нарушения вышеперечисленных жизненно-важных механизмов. Эти клеточные механизмы, в свою очередь, как и все остальные функции клетки, зашифрованы в генетическом коде каждой клетки. Соответственно, возникновение опухолей из нормальных клеток во многом обусловлено нарушением участков генетического кода, отвечающих за эти важнейшие для жизни механизмы.
Генетический код, как программа жизни клеток и организма в целом.
В настоящее время известно, что вся вся информация о строении и функционировании нашего организма (генетический код) зашифрована в структуре особых молекул, представляющих собой цепочки ДезоксирибоНуклеиновой Кислоты (молекулы ДНК). Так, каждый организм на этапе зачатия получает генетический код зашифрованный в молекулах ДНК половых клеток родителей (яйцеклетка и сперматозоид), а затем, по мере роста организма, клетки делятся и копии генетического кода передаются дочерним клеткам. В итоге, все клетки взрослого организма содержат копии ДНК половых клеток родителей. Если в какой-либо клетке происходит изменение кода ДНК, все последующие поколения клеток несут в себе этот измененный код.
С современной точки зрения ДНК можно представить себе, как программу которую организм получает с момента зачатия и в которой закодированы идеи о том, как должен выглядеть и функционировать организм в целом и каждая отдельная клетка. Однако в ДНК могут возникать поломки и ошибки копирования, что может привести к изменению или сбою в программе жизни клетки. В случаях когда поломка ДНК приводит к изменению генетического кода, последствия зависят от масштабов изменения и от того, в какой части кода ДНК они произошли. Кроме того, последствия изменения генетического года зависят от этапа развития организма на котором произошло изменение кода ДНК. При возникновении изменения структуры ДНК даже в одной единственной клетке на зародышевом этапе развития, это может привести к изменению формирования целых органов происходящих из этой клетки, а также к изменению отдельных функций организма. У взрослого человека изменение кода ДНК в отдельно взятой клетке может привести к заметным и серьезным последствиям только в том случае, если эти изменения вызовут бесконтрольное деление клетки, то есть образование опухоли.
Что такое мутации?
Стойкие изменения генетического кода (в молекулах ДНК), которые затем передаются в процессе деления дочерним клеткам в медицинской терминологии называют мутациями. Мутации могут затрагивать отдельные клетки, когда возникают у взрослых. Либо мутации могут вовлекать целые органы и части организма, как следствие возникновения на зародышевом этапе развития и последующего тиражирования в процессе деления клеток по мере роста зародыша. Если мутации затрагивают половые клетки родителей или возникают во время зачатия, тогда такие мутации распространяются на весь организм. Это происходит из-за того, что мутации в ДНК, однажды возникнув в половых клетках, так и продолжают тиражироваться во все дочерние клетки по мере их деления и роста зародыша.
Кроме мутаций, существуют и другие механизмы влияющие на работу клеточной программы: механизмы регулирующие считывание кода ДНК. Эти механизмы способны "усыплять" либо активировать считывание определенных участков кода ДНК и носят, как правило, обратимый характер. В нормальных клетках эти механизмы обеспечивают активацию только тех генов, которые нужны в данным момент для их функции, а также позволяют быстро адаптироваться к изменениям окружающей среды. Например в клетках желудка активны гены отвечающие за выработку соляной кислоты, но эти же гены неактивны в других клетках организма. В случае негативных воздействий на клетку, такие механизмы позволяют быстро активировать генетический код и начать выработку соответствующих белков отвечающих, например, за устойчивость клетки к повышенной температуре или каким-либо другим неблагоприятным факторам. Такие регуляторные механизмы также могут играть определенную, чаще вспомогательную, роль в возникновении, развитии опухолей, а также в выработке опухолевыми клетками устойчивости к воздействию химиопрепаратов или способности к метастазированию.
Роль сохранения и передачи генетической информации в возникновении опухолей

Генетическая информация, закодированная в ДНК, передается из поколения в поколение от родителей к детям. При этом изменения в коде ДНК могут возникать на любых этапах: в половых клетках, на этапе зачатия, во время внутриутробного развития и в процессе жизни. Они могут возникать спонтанно либо под действием внешних факторов, во время деления либо между делениями клетки. Образовавшиеся в определенных участках генетического кода изменения могут приводить к образованию опухолей. Такие участки генетического кода, связанные с развитием опухоли, называют онкогенами и онкосупрессорами. Многие из онкогенов и онкосупрессоров в нормальном состоянии отвечают за вышеперечисленные важные функции: клеточное деление, взаимодействие клеток между собой и организмом. Повреждения в этих генах может привести к возникновению бесконтрольного и "бесконечного" деления клетки, что превращает нормальную клетку в опухолевую и, таким образом, приводит появлению и росту опухоли. Таким образом, ошибки копирования ДНК и деления клеток, а также физические, химические и биологические факторы воздействия, способные изменить (повредить) ДНК, могут привести к появлению опухоли в том случае, если повреждение затронет определенные участки генетического кода (онкогены или онкосупрессоры).
Интересно также, что во время копирования ДНК и в процессе деления клетка более уязвима к внешним факторам, способным повредить ДНК. Таким образом, под воздействием внешних факторов повреждающих ДНК больше всего страдают активно делящиеся клетки организма, такие как слизистые оболочки (эпителий) покрывающие изнутри полые органы. Именно из этих оболочек возникает рак, который является наиболее часто встречающейся разновидностью злокачественных опухолей. Например клетки эпителия желудка настолько интенсивно делятся, что эпителий желудка полностью обновляется в течение 5 дней. При этом рак желудка является одним из самых распространенных раковых заболеваний.
Почему возникают спонтанные поломки и изменения генетического кода (мутации)?
Перед тем как разделиться, клетке необходимо скопировать молекулы ДНК, чтобы каждая из дочерних клеток получила свою копию генетического кода. Копирование молекул ДНК человека чрезвычайно сложный процесс: линейный размер молекул ДНК в одной клетке составляет около 2 метров, при этом внутри клеток эти молекулы компактно скручены в сложные спирали. В молекулах ДНК клетки человека содержится более 3 миллиардов пар нуклеотидов ("кирпичиков" из которых построена молекула), каждую из которых необходимо скопировать, при этом весь процесс копирования в клетке человека занимает около 7-10 часов. Затем получившиеся копии разводятся по разным полюсам клетки, после чего клетка делится пополам и каждый из полюсов становиться новой клеткой. С учетом колоссальной сложности вышеописанного процесса, а также с учетом того, что в организме в процессе жизни происходят не одна тысяча клеточных делений, становится объяснимым возникновение спонтанных сбоев во время копирования и разделения генетического кода, даже при благоприятных условиях. Искажения генетического кода возникающие во время копирования ДНК и деления клеток непредсказуемы и могут быть различными по масштабам и расположению измененного участка кода. Соответственно, последствия таких поломок также непредсказуемые. Подобно лотерее, все зависит от того, в какой части генетического кода произошел сбой, от особенностей и масштабов этих изменений.
Не стоит думать, что все мутации вредные. Случайным образом возникшие мутации могут придавать новые полезные свойства клеткам и организму в целом, и носители таких мутаций будут иметь преимущество в процессе естественного отбора. Например, некая случайно-возникшая мутация может придать устойчивость к некой смертельной инфекции, и носители такой мутации смогут выжить в условиях эпидемии, а остальные погибнут. Таким образом, произойдет естественный отбор в пользу данной мутации. В итоге, эта мутация позволит выжить её носителям, а также обеспечит врожденный иммунитет к этой инфекции у последующих поколений в случае, если мутация затронула половые клетки.

ДНК-репаразы: ремонтные белки защищающие генетический код от спонтанных и вызванных внешними факторами поломок и изменений (мутаций).
Интересно, что в клетках человека предусмотрены специальные белки (ДНК-репаразы), отвечающие за ремонт после ряда наиболее распространенных и типичных поломок ДНК во время копирования и деления клеток, а также после воздействия неблагоприятных факторов. Нарушение функции ДНК-репараз может приводить к заболеваниям, в том числе к онкологическим. В настоящее время известны и изучены многие из этих ремонтных белков, соответственно, по ним может быть проведена индивидуальная генетическая диагностика риска развития заболевания. Врожденных дефекты ДНК-репараз проявляются высоким риском развития злокачественных опухолей, в том числе, в молодом возрасте, а также врожденными генетическими заболеваниями. Так, например, врожденные дефекты определенных ДНК-репараз вызывают повышенный риск развития рака груди (ДНК-репаразы закодированные в генах: BRCA1, BRCA2, HRR, ATM и другие), яичников (гены BRCA1, BRCA2 и др.), кожи (гены XPC, XPE и др.), а также ряда других онкологических заболеваний. Генетический анализ в настоящее время достаточно дорогая процедура и рекомендуется чаще при наличии семейной истории раковых заболеваний в нескольких поколениях, а также при наличии семейной истории онкологических заболеваний в молодом возрасте с целью определения индивидуального риска развития онкологических заболеваний. Такая диагностика позволяет выявить вредные мутации в определенных генах отвечающих за предрасположенность к онкологии, в том числе в генах кодирующих ДНК-репаразы. При обнаружении вредных мутаций в клетках пациента, его предупреждают о высоком риске развития определенных онкологических заболеваний, а также предлагают меры профилактики и раннего обнаружения болезни.
Различные врожденные дефекты в генах ДНК-репараз могут быть незаметны и лишь предрасполагать к онкологии, а могут проявляться серьезными последствиями уже с раннего возраста в виде ярко выраженных генетических заболеваний. Среди врожденных заболеваний, вызванных дефектом ДНК-репараз , можно отметить прогерию - заболевание, при котором нарушение ДНК-репаразы (кодируемой геном LMNA) приводит к преждевременной гибели клеток. Проявляется прогерия преждевременным старением всего организма: так при рождении дети выглядят нормальными, затем медленно растут и стремительно стареют, в 13 лет они выглядят как дряхлые старики, и только единицы из этих детей живут дольше 20 лет.
Врожденный дефект ДНК-репараз, отвечающих за восстановление поломок ДНК после воздействия ультрафиолета на кожу, проявляется другим заболеванием - пигментной ксеродермой. Клетки кожи таких людей беззащитны к нарушениям ДНК вызванным ультрафиолетом, при том что такие поломки ДНК эффективно устраняются у здоровых людей с помощью ДНК репараз. Как следствие, при этом заболевании в результате попадания солнечного света на коже образуется воспаление и ожоги, а в последующем у таких больных развиваются множественные злокачественные опухоли кожи. Также изучен целый ряд других редких врожденных заболеваний вызванных дефектами ДНК-репараз, а также выявлены мутации ответственные за развитие этих болезней.
Как процессы копирования ДНК и деления клеток связаны с чувствительностью опухолей к химиотерапии?
Как уже было отмечено выше, в клетках могут развиваться "спонтанные" изменения генетического кода из-за ошибок копирования ДНК и деления клеток. Но помимо этого, во время копирования ДНК и деления клеток отмечается повышенная чувствительность молекул ДНК к поломкам под воздействием внешних факторов, так как молекулы ДНК во время этих процессов находятся в "рыхлом" состоянии и менее стабильны. Между этапами деления в клетках также могут случаться поломки ДНК под воздействием различных факторов, однако при этом ДНК менее чувствительна к поломкам, т.к. большая ее часть находится в компактном более стабильном состоянии.
Именно на этой особенности основано действие многих химиопрепаратов, нарушающих структуру молекул ДНК. Такие химиопрепараты в большей степени поражают активно делящиеся опухолевые клетки, чем здоровые клетки. Поэтому опухоли, в которых отмечается высокая активность деления клеток, потенциально более чувствительны к таким химиопрепаратам.
| Как превратить нормальную клетку в опухолевую? |
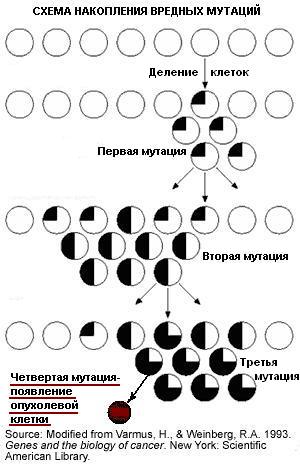
В настоящее время наука позволяет целенаправленно изменять в живой клетке практически любые гены, а также располагает информацией о функциях многих генах, в том числе, связанных с возникновением опухолей. В экспериментах на животных было показано, что для превращения нормальной клетки в опухолевую, недостаточно изменить какой-либо один ген, а необходимо изменить целый ряд генов. То же самое происходит и в организма человека: чтобы возникла опухоль, необходимо накопление вредных мутаций в генах ответственных за превращение нормальной клетки в опухолевую (онкогенах и онкосупрессорах). Исходя из этого становится ясно, что если в клетках организма уже есть врожденные дефекты генов способствующие трансформации нормальной клетки в опухолевую, то будет склонность к развитию опухолей. Человек с такими врожденными генетическими дефектами может не подозревать об их наличии, но будет на один шаг ближе к развитию опухоли, и рискует заболеть в более раннем возрасте, поскольку для появления опухоли его клеткам понадобится накопить меньшее количество мутаций. Если предположить, что для развития некой опухоли требуется минимум 5 мутаций в определенных генах, и 1 одну из этих мутаций человек уже получил с рождения от родителей, тогда можно говорить о наследственной предрасположенности к развитию этой опухоли, как у родителя-носителя мутации, так и у этого человека. Ярко выраженная онкологическая предрасположенность наблюдается при врожденных мутациях в генах ДНК-репараз, поскольку при нарушенной работе этих белков, отвечающих за ремонт ДНК, в клетках быстрее накапливаются мутации.
Соответственно, с возрастом в различных клетках человека накапливаются мутации, и чем человек старше, тем их больше. А чем больше накопилось мутаций, тем больше вероятность возникновения и накопления среди них вредных мутаций, и, соответственно, вероятность развития опухолей. Кроме того, мутации накапливаются тем быстрее, чем больше вредных факторов воздействует на ДНК клеток.
Таким образом, чем больше "вредных" изменений в ДНК человек получил с рождения (наличие врожденной предрасположенности), чем больше возраст, и чем больше вредных воздействий оказано на человека, тем выше вероятность появления опухоли.
Какие факторы могут приводить к нарушениям и изменениям генетической информации зашифрованной в ДНК (мутациям):
Можно выделить следующие основные факторы способные, воздействуя на ДНК клеток, вызвать стойкое повреждение генетического кода (мутации):
- Физические факторы (ионизирующая радиация, ультрафиолетовое излучение)
- Химические факторы (канцерогены, свободные радикалы)
- Биологические факторы (вирусы, воспалительные процессы)
Факторы способные вызывать развитие злокачественных опухолей называют канцерогенами (от английского cancer, производное от греческого karkinos – рак, краб).
Роль физических факторов в повреждении ДНК и возникновении опухолей.
 Естественный радиационный фон, а также естественное ультрафиолетовое излучение солнца могут воздействуя на ДНК клеток вызывать мутации. Однако, поскольку интенсивность этих природных излучений не столь высока, то и мутации под их воздействием происходят не так часто, но безусловно они случаются и накапливаются в течении жизни.
Естественный радиационный фон, а также естественное ультрафиолетовое излучение солнца могут воздействуя на ДНК клеток вызывать мутации. Однако, поскольку интенсивность этих природных излучений не столь высока, то и мутации под их воздействием происходят не так часто, но безусловно они случаются и накапливаются в течении жизни.
УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ. У светлокожих людей механизмы защиты от ультрафиолетового излучения менее развиты. Соответственно, во время пребывания под интенсивным ультрафиолетовым облучением у них повышен риск возникновения и накопления мутаций в клетках кожи, что может привести к возникновению опухолей кожи. Такое может случиться в результате длительного, либо частого прибывания в жарких странах и при увлечениях солярием. У светлокожих людей проживающих в жарких странах до 10 раз чаще развивается рак кожи, чем у коренных жителей.
ИОНИЗИРУЮЩАЯ РАДИАЦИЯ. Естественный радиационный фон способен вызывать мутации и вносит некоторый вклад в развитие опухолей. В то же время, естественный радиационный фон приводит к мутациям и в половых клетках, которые могут оказаться не только вредными, но и полезными. Периодическое возникновение таких мутаций имеет важное значение для процесса эволюции. Новые полезные мутации возникающие в половых клетках дают преимущество потомству в борьбе за выживание и размножение, сохраняются и передаются следующим поколениям в процессе естественного отбора.
Небольшой уровень радиации является естественным природным фактором, источниками ее являются солнечное излучение, земля и воздух. Живые организмы достаточно хорошо адаптированы к естественной радиации. Однако, кроме естественного радиационного фона в современном мире существует ядерное оружие, при использовании которого радиационный фон повышается во много раз. Также на планете существуют места с высоким содержанием радиоактивных элементов и, соответственно, высоким радиационным фоном. Интересно также, что радиоактивный газ радон содержащийся в земле и создающий естественный радиационный фон, будучи тяжелее воздуха способен в опасных концентрациях накапливаться в подвалах зданий.
При высокой дозе радиактивного излучения в ряде клеток происходят несовместимые с жизнью клетки мутации, а также другие повреждения. В первую очередь поражаются и погибают активно делящиеся клетки, в которых молекулы ДНК находятся в менее стабильном состоянии. Наиболее активно делящимися и уязвимыми в организме являются клетки костного мозга, слизистые оболочки выстилающие изнутри органы желудочно-кишечного тракта (ротовая полость, пищевод, желудок, тонкая и толстая кишка), клетки кожи. Другие клетки также подвержены повреждениям, при этом радиация поражает не только ДНК, но и различные другие внутриклеточные структуры и молекулы. Последствия воздействия на организм высоких доз радиации называют лучевой болезнью. Даже после того, как человек пережил воздействие радиации и острый период лучевой болезни, в его организме остается множество клеток с мутациями. Часть из этих мутаций являются вредными и поражают участки ДНК (так называемые онкогены и онкосупрессоры) связанные с возможным развитием опухоли. Клетки накопившие вредные мутации находятся на шаг ближе к превращению в опухоль, что проявляется высоким риском возникновения опухолей у людей подвергшихся высоким дозам радиации.
ЛУЧЕВАЯ ТЕРАПИЯ. Высокие дозы радиации могут быть использованы и в лечебных целях для воздействия на опухоли. Многие опухоли являются уязвимыми к воздействию радиации поскольку в них много активно делящихся клеток. Использовании радиации в качестве лечебного инструмента называют лучевой терапией. При этом с помощью сложных пространственных расчетов стараются ограничить область максимального облучения границами пораженных тканей и при этом снизить дозы облучения окружающих тканей за счет распределения суммарной дозы по большей площади. Несмотря на это, лучевая терапия, в некоторых случаях, может вызывать развитие новых опухолей в отдаленные сроки после лечения.
 Роль химических факторов в повреждении ДНК и возникновении опухолей.
Роль химических факторов в повреждении ДНК и возникновении опухолей.
Человек в течение всей жизни контактирует с различными химическими веществами. Канцерогенные химические вещества, способные изменять генетический код и вызывать развитие опухолей, могут образововаться в результате естественных химических реакций во время горения природных материалов, во время копчения и жарки пищи, в несвежих продуктах питания и т.д. В то же время, с развитием индустриализации и химической промышленности резко увеличилось количество вредных химических веществ в воздухе и воде, а также в продуктах питания, в средствах химической чистки, в косметике, в лако-красочных материалах и др. Можно только догадываться о содержании канцерогенов в жару над детскими площадками покрытыми резиновой крошкой из переработанных покрышек (такое покрытие стало "популярным" в Москве). Данных об исследованиях безопасности таких площадок найти не удалось, однако доказано, что автомобильная резина при горении и нагревении выделяет токсичные вещества и канцерогены.
Многие из канцерогенных веществ проникая в организм человека способны вызывать поломки в молекулах ДНК, изменяя таким образом генетический код. Что касается продуктов питания, канцерогены образуются не только в жареных и копченых продуктах, они также могут образовываться в процессе промышленной обработки продуктов питания или быть добавлены в виде консервантов, красителей и т.п. Содержащиеся в удобрениях канцерогены могут накапливаться в овощах и фруктах, а из них либо сразу попадать в организм человека, либо сначала накапливаться в организмах домашних животных. В настоящее время известно множество химических соединений, однако лишь некоторые из них проверены на способность вызывать злокачественные опухоли. Отсутствие данных о канцерогенности какого-либо химического соединения, может быть связано с отсутствием соответствующих исследований и не гарантирует безопастность этого вещества. Такие исследования, проводимые на должном уровне, чрезвычайно сложны и дороги, учитывая, что развитие рака в из-за контактов с канцерогенами может произойти спустя годы и требуются длительные эксперименты на животных, а также масштабные эпидемиологические исследования. В зависимости от уровня доказанности канцерогенного эффекта, канцерогены разделяются на классы, при этом к I классу причисляются вещества с несомненной канцерогенной активностью, а списки канцерогенных веществ постоянно дополняюся. По многим, наиболее распространенным канцерогенам содержащимся в воде, воздухе и продуктах питания накоплено немало информации, которую можно почерпнуть в интернете. Решить проблему защиты от вышеперечисленных канцерогенов можно только с участием государства, благодаря проведению научных исследований по выявлению новых канцерогенов и введению жестких норм контроля за содержанием канцерогенов в воздухе, еде и воде.
 По сути полностью оградить себя от канцерогенов невозможно. Однако стоит помнить, что эффект от воздействия канцерогенов пропорционален дозе и продолжительности воздействия. Кроме того, эффект от воздействия различных канцерогенных факторов может суммироваться. Особое значение в связи с этим принимает защита работников различных вредных предприятий от контакта с канцерогенами. Благодаря повышенному уровню онкологической заболеваемости на вредных производствах удалось выявить и доказать канцерогенную активность целого ряда химических веществ. Печально, что до сих пор на ряде предприятий не решена проблема максимальной изоляции людей от контакта с канцерогенами, что продолжает приводить к повышенной онкозаболеваемости среди сотрудников. Необходимо стремиться если не к полной изоляции от канцерогенов, то хотя бы к снижению их концентрации и продолжительности контакта. Кроме того, необходимо помнить, что эффект от воздействия различных канцерогенных факторов (то есть степень риска развития опухолей) может суммироваться и накапливаться.
По сути полностью оградить себя от канцерогенов невозможно. Однако стоит помнить, что эффект от воздействия канцерогенов пропорционален дозе и продолжительности воздействия. Кроме того, эффект от воздействия различных канцерогенных факторов может суммироваться. Особое значение в связи с этим принимает защита работников различных вредных предприятий от контакта с канцерогенами. Благодаря повышенному уровню онкологической заболеваемости на вредных производствах удалось выявить и доказать канцерогенную активность целого ряда химических веществ. Печально, что до сих пор на ряде предприятий не решена проблема максимальной изоляции людей от контакта с канцерогенами, что продолжает приводить к повышенной онкозаболеваемости среди сотрудников. Необходимо стремиться если не к полной изоляции от канцерогенов, то хотя бы к снижению их концентрации и продолжительности контакта. Кроме того, необходимо помнить, что эффект от воздействия различных канцерогенных факторов (то есть степень риска развития опухолей) может суммироваться и накапливаться.
Отдельно необходимо отметить курение, как причину развития рака, ответственность за которую полностью лежит на самих больных раком. В табачном дыму содержится по меньшей мерее 15 канцерогенных веществ. Это повышает риск развития рака легкого среди курильщиков примерно в 10 раз по сравнению с некурящими людьми. Кроме того, табачный дым воздействует и на другие органы, и способен вызывать, в том числе, рак губы, рак полости рта, языка, пищевода и желудка. Обнадеживающим фактором для курильщика служит тот факт, что после того, как человек бросил курить, риск развития рака легкого снижается почти до минимального примерно через 5 лет. В то же время курильщики, порой не задумываясь об этом, способны вызвать развитие рака у окружающих некурящих людей (пассивное курение). Осознание вышесказанного привело к постепенному ужесточению антитабачного законодательства, что дает надежду на снижение в будующем количества больных раком легкого и других органов. Из вредных привычек также стоит отметить регулярное употребление острой пищи и крепких алкогольных напитков, что может приводить к развитию рака пищевода и желудка.
Роль биологических факторов в повреждении ДНК и возникновении опухолей.
Целый ряд вирусов вызывать определенные онкологические заболевания у животных. Заражение животных некоторыми чрезвычайно канцерогенными вирусами приводит к развитию опухолей практически в 100% случаев. У человека также был выявлен ряд онкологических заболеваний ассоциированных с наличием вирусного поражения: при заражение Вирусом Иммунодефицита Человека (ВИЧ) развивается саркома Капоши, при поражении вирусом гепатита очень часто развивается рак печени, поражения некоторыми разновидностями вируса папилломы человека приводит к частому развитию рака шейки матки и т.д. Канцерогенное действие вирусов связано с тем, что генетический материал таких вирусов уже содержит все или часть генов необходимых для превращения здоровой клетки в опухолевую. После проникновения вирусов в здоровые клетки, эти гены активируются и затем активирует механизмы бесконтрольного деления клеток и т.п. На примере Гепатита В стоит отметить, что не у всех больных развивается рак печени. Кроме того, у больных раком печени, ассоциированном с Гепатитом В, он развивается через различное, порой длительное, время после заражения. Таким образом, хотя, роль вирусов в развитии определенных видов опухолей не вызывает сомнений, их воздействия бывает недостаточно. Чаще всего они лишь приближают к развитию опухоли, но для окончательного возникновения злокачественного заболевания необходимы дополнительные изменения.
Бактерии, в отличии от вирусов, как правило не вносят свой генетический материал в клетку человека. Однако вызывая хронические воспалительные процессы бактерии способны провоцировать развитие раковых заболеваний. Во время воспалительных процессов возможно выделение различных веществ разрушительно воздействующих на генетический код клеток, то есть, способных вызвать мутации. Так, например, доказано, что хроническое воспаление желудка связанное с ростом бактерией Helicobacter pylori ассоциируется с высоким риском развития рака желудка. На основании этого бактерию Helicobacter pylori относят к канцерогенным факторам.
Роль деления клеток и межклеточных взаимодействий в возникновении и развитии опухолей
В здоровом организме происходит постоянное отмирание клеток, на смену которым приходят новые. Новые клетки не возникают из ниоткуда, а являются результатом деления "стволовых" клеток. Стволовые клетки обычно не выполняют специализированных функций, а служат поставщиками новых клеток в организме. После деления стволовой клетки на две, в одной из клеток может активироваться генетический код отвечающий за специальные функции (например гены отвечающие за выработку соляной кислоты в клетках желудка). Тогда как другая клетка может так и остаться стволовой и служить источником пополнения новыми клетками. Специализированные клетки хоть и возникают путем деления стволовых клеток, но после активации генов отвечающих за их функцию, они приступают к своей работе, утрачивают способность к делению и со временем просто погибают. Способность стволовых клеток делиться заключает в себе риск образования опухолей из этих клеток в тех случаях, когда утрачиваются механизмы сдерживающие их деление или наоборот активируются механизмы стимулирующие их деление. Кроме постоянного обновления клеток организма стволовые клетки также участвуют в процессах заживления после ранений и других деструктивных процессов в организме. Действительно, после ранения кожи можно наблюдать как затягивается рана. Это происходит потому, что существуют механизмы активации стволовых клеток. Но в какой-то момент процесс появления новых клеток кожи путем деления стволовых клеток останавливается, это свидетельствует о включении механизмов останавливающих деление. Механизмы эти достаточно сложные, но при этом необходимо отметить, что значительную роль играет способность клеток в области ранения сначала подавать активирующие сигналы стволовым клеткам и тормозящие, по мере заживления раны. Такие сигналы передаются за счет выделения клетками вовне сигнальных молекул (медиаторов), а воспринимаются другими молекулами (рецепторами) встроенными в мембрану (оболочку) клеток. Рецепторы подобно антенам принимают сигнальные молекулы и активируют определенные генетически обусловленные программы внутри клетки. Если определенная клетка выделяет сигнальные молекулы, то в первую очередь сигнал примут соседние клетки вокруг которых будет максимальная концентрация этих молекул. А теперь, предположим, что рецепторы отвечающие за деление клетки постоянно активны, вне зависимости от наличия сигнальных молекул. Такое может произойти при так называемых активирующим мутациях в генах отвечающих за такой рецептор, результатом будет бесконтрольное деление клетки и, в итоге, образование опухоли. А если в такой мутированной клетке произойдет вторая мутация, активирующая бесконтрольную выработку стимулирующих молекул? Тогда мы будем иметь опухоль активирующую рост соседних здоровых клеток. Такое часто наблюдается в опухолях, поскольку опухоли, чтобы выжить нужно питаться, а питание происходит либо за счет диффузии из здоровых тканей или по кровеносным сосудам вросших в саму опухоль. Диффузия не может обеспечить питание больших опухолей. По мере роста опухоли питающиеся за счет диффузии будут распадаться в своей толще из-за нехватки кислорода и питательных веществ и не смогут достигнуть размера большего, чем порядка 0,5-1см . Однако, поскольку злокачественные опухоли характеризуются повышенной склонностью к мутациям (за счет деффектных ДНК-репараз и др. факторов), рано или поздно в опухоли может возникнуть мутация активирующая бесконтрольную выработку фактора роста сосудов. Молекулы фактора роста сосудов активируют стволовые клетки окружающих опухоль капилляров, что приводит к прорастанию сосудов в толщу опухоли и позволяет клеткам в толще опухоли хорошо питаться, а опухоли - неограниченно расти. В доброкачественные опухоли также могут проникать сосуды, поскольку даже в норме клетки страдающие от нехватки кислорода и питательных веществ способны вырабатывать фактор роста сосудов.
Кроме механизмов взаимодействия между соседними клетками, существуют и гормональные взаимодействия распространяющие гормональные сигналы через кровь по всему организму. Некоторые гормоны способны стимулировать деление клеток. Например, эстрогены стимулируют рост клеток молочной железы на поверхности которых имеются соответствующие эстрогеновые рецепторы. Активирующие мутации в системе эстрогеновых рецепторов вызовут самостимуляцию клетки к делению и приведут к образованию опухоли.
Необходимо отметить, что темпы роста злокачественных опухолей более соответствуют геометрической прогрессии и у каждой опухоли существует свое время полуудвоения массы. Из этого следует, что путь роста опухоли от нескольких миллиметров до 10 см может занимать гораздо больше времени, чем увеличение с 10 до 20см. Предположим, что время полуудвоения опухоли составляет 6 месяцев, тогда для увеличения опухоли от 1 сантиметра до 20 сантиметров понадобится чуть более двух лет, а для увеличения с 20 сантиметров до 40 сантиметров понадобится всего полгода. А в следующие полгода опухоль должна будет увеличиться до 80см, что, вероятно, несовместимо с жизнью. Этот грубый подсчет, который дает некоторое понимание наблюдаемого долгого бессимптомного роста опухоли с последующим резким ухудшением. А также дает понимание ответа на вопрос: когда возникла эта опухоль? Учитывая, что размер опухолевой клетки составляет одну тысячную сантиметра (10 микрон), можно в нашем примере вычислить сколько могло пройти времени от возникновения опухолевой клетки до того, как она выросла до 10см - это около 7 лет. Конечно это не точный расчет, поскольку по разным причинам темпы роста опухоли могут, как замедляться, так и ускоряться.
Таргетные препараты как плоды изучения механизмов развития опухолей
Изучение вышеописанных механизмов взаимодействия клеток и обнаружение способности опухолевых клеток к самостимуляции, как своего роста, так и роста окружающих здоровых клеток (клеток сосудов) привело к появлению новых противоопухолевых препаратов. Эти препараты точечно воздействуют на определенные рецепторы клеток или другие молекулярные механизмы отвечающие за деление клеток и развитие опухолей. За прицельное воздействие на уровне молекулярных механизмов, такие препараты называют таргетными (target - цель). Так например, один из таких таргетных препаратов воздействует на рецепторы фактора роста сосудов, замедляя проникновения в опухоль новых сосудов и замедляя таким образом рост опухоли в целом. Существует целая серия таких препаратов, применяемых при различных злокачественных опухолевых заболеваниях уже на протяжении ряда лет. Постоянно появляются новые таргетные препараты. Эффективность этих препаратов различная и не всегда соответствует ожиданиям. К положительным моментам применения таргетных препаратов относится отсутствие тошноты, рвоты, выпадения волос и других нежелательных эффектов благодаря значительно меньшему воздействию на здоровые ткани по сравнению с обычной химиотерапией. Однако опухолевые клетки обладают повышенной способностью к мутациям, поэтому под давлением естественного отбора клетки с мутациями позволяющие избежать воздействия таргетных препаратов или химиопрепаратов могут выжить и развиваться дальше. Способность опухолей в ряде случаев приобретать устойчивость к воздействию терапии стимулирует изучение новых препаратов и молекулярных механизмов устойчивости.
Роль имунной системы в защите от опухолей
Имунная система защищает организм от чужеродных клеток бактерий, способна убивать клетки зараженные вирусами. Существует целая система опознания своих клеток: на каждой клетке человека присутствует уникальный код построенный из специальных молекул. Этот код может быть прочитан клетками имунной системы. Именно по этому коду подбираются донорские органы для пересадки. Идеально подобрать этот код не удается, поэтому после пересадки донорских органов пациент получает лекарства подавляющие имунную систему, чтобы она не реагировала на чужеродный опознавательный код. Описан интересный случай рака пересаженной почки с метастазами. При этом, после отмены лекарств подавляющих имунную систему, метастазы были успешно уничтожены собственной имунной системой пациента, как чужеродные клетки. Иначе обстоит дело с опухолями собственных тканей человека. Поскольку опухолевые клетки возникают из нормальных клеток организма путем мутаций, они несут на себе тот же самый код, что и остальные клетки организма и не вызывают большой озабоченности со стороны имунной системы. Все же есть данные о том, что имунная система в определенных случаях может подавлять возникновение опухолей, однако этот вопрос требует дальнейшего изучения.
Заключение: наша цель "поймать" опухоль на этапе ее возникновения
В заключение хочется отметить, что в России более половины опухолевых заболеваний выявляются в запущенной стадии. При этом чаще всего виноваты сами больные из-за общемедицинской неграмотности, из-за невнимательного отношения к своему здоровью, из-за вредных привычек, нежелания выделить личное время на обследование, лишний раз сходить к врачу при появлении симптомов и так далее. Совместными усилиями государства и жителей может быть минимизирован контакт с канцерогенами. Благодаря профилактическим осмотрам стали чаще выявляться онкологические заболевания в начальных стадиях, когда есть все шансы на излечение. Необходимо строго придерживаться практики профилактических осмотров, особенно после 50 лет. В самом деле, для многих людей не столь важно откуда и почему возникла опухоль, чем выявить опухоль в самых начальных стадиях, когда еще нет никаких симптомов. Важно выявить заболевание, когда человек чувствует себя абсолютно здоровым и не подозревает, что где-то в организме растет опухоль. Чаще всего бывает, что опухоли размерами даже в 5см и более не дают никаких симптомов (в этом все коварство злокачественных опухолей), но при этом они легко выявляются при хорошем обследовании. Можно рекомендовать профилактическое обследование раз в год, а лучше раз в полгода:
Пример списка профилактического онкологического обследования:
Органов дыхательной системы:
- флюорография(наименьшая лучевая нагрузка)
- или рентгенография грудной клетки
- или компьютерная томография (наибольшая информативность, способность выявлять минимальные опухоли) грудной клетки
Органов брюшной полости:
- УЗИ брюшной полости (нет лучевой нагрузки)
- компьютерная томография брюшной полости (обычно в случае подозрительных изменений по данным УЗИ)
Желудка и пищевода:
- эзофагогастроскопия является единственным методом выявления ранних форм рака пищевода и желудка
Кишечника:
- профилактический осмотр колопроктолога, анализ кала на скрытую кровь, колоноскопия, КТ-колоноскопия
Молочных желез:
- профилактический осмотр у маммолога
- маммография и УЗИ молочных желез являются взаимодополняющими методами (по рекомендации маммолога)
Женских половых органов:
- профилактический осмотр у гинеколога
Мужских половых органов:
- профилактический осмотр уролога, УЗИ простаты, анализ крови на простатспецифический антиген
Кожи:
- регулярный самостоятельный осмотр кожи и незамедлительное обращения к онкологу при появлении новых кожных образований, а также при росте или изменениях уже имеющихся кожных образований
К исследованиям способным выявить опухоль почти в любой области организма можно отнести Позитронную Эмиссионную Томографию, которая позволяет выявлять большинство видов злокачественных опухолей при размерах от 1 сантиметра и более (то есть на ранних стадиях). Из-за дороговизны это исследование в настоящее время не используется в качестве профилактического обследования, а назначается для уточниния распространенности опухолевого процесса или для выявления признаков злокачественности опухолевидных образований в сложных случаях. Безусловно за этим методом будующее.
В настоящее время есть возможность определять в крови особые молекулы - онкомаркеры, повышенные концентрации которых могут наблюдаться при различных опухолях. Практически мало какие из онкомаркеров в настоящее время используются для обнаружения опухолей. Вместо этого их определяют, как правило, при уже имеющихся данных за наличие опухоли. Это связано с тем, что большинство онкомаркеров в крови повышается при уже достаточно больших размерах опухолей, а многие опухоли и вовсе растут без повышения уровня онкомаркеров в крови. Из всех онкомаркеров для выявления широко применяется в настоящее время лишь простатспецифический антиген (ПСА) определяемый в повышенных концентрациях при раке предстательной железы. Остальные онкомаркеры больше используются для установления вида опухоли (онкомаркеры ХГЧ и АФП свидетельствуют о наличии герминогенной опухоли, повышение онкомаркера СА125 характерно для рака яичников и т.д.) и для контроля за эффективностью лечения, но только в том случае если наблюдался повышенный уровень онкомаркеров в начале лечения. То есть, на основании динамики изменения концентрации онкомаркеров в крови можно судить об эффективности лечения.
Для более подробного и индивидуального плана профилактических обследований, а также для определения противопоказаний необходимо консультироваться с онкологом и профильными специалистами.
© Григорчук Александр Юрьевич, 2014 | Все права защищены
ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ:
Error: No articles to display